Биосовместимые Пиколил-Азиды |
 |
Наиболее известной CLICK реакцией является Cu(I)- катализируемая реакция Азид - концевой Алкин (CuAAC) с использованием таких метаболитов, как 5-EdU, 5-EU или O-Пропаргил-пуромицин с последующей детекцией Азидными реагентами (Азиды флуоресцентных красителей, (Дестио)Биотинилированные Азиды или FLAG Азиды).
Но по причине токсичности Cu(I) использование реакции CuAAC в живых клетках является затруднительным. Эту проблему можно решить с использованием лигандов, хелатирующих Cu(I) таких как THPTA, которые служат двум целям: 1) Ускоряют реакции CuAAC, поддерживая степень окисления Cu(I) и 2) Защита биомолекул от окислительного повреждения.[1,2]
Пиколил-Азиды выводят рекацию CuACC на новый уровень биосовместимости и эффективности:[3,4,5]
- они обладают медь-хелатирующей группой и потому требуют намного меньшей концентрации меди (≥ 10 µM) для достижения аналогичной эффективности реакции сравнительно с традиционными Азид-реагентами (≥ 100 µM) (Таблица. 1)
- они значительно повышают эффективность мечения при использовании в классических условиях медь-катализируемой клик-рекации (100 µM CuSO4 + 500 µM THPTA)[3]
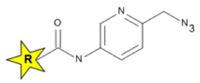
Таблица 1: Пиколил-Азиды требуют в 10 раз меньше меди для достижения эффективности традиционных Азид-реагентов.
R = Флюорофор, (Дестио)биотин или FLAG.
| Азид[1,2] | Пиколил-Азид[3] | |
| Вспомогательный CuAAC реагент |  |
 |
| CuSO4 | 100 µM – 250 µM[1,2] | 10 µM – 100 µM[3] |
| THPTA | 500 µM – 1.25 mM[1,2] | 50 µM – 500 µM[3] |
| Аскорбат натрия | 5 mM – 12.5 mM[1,2] | 500 µM – 5 mM[3] |
| Соотношение CuSO4 : THPTA | 1 : 5 | |
| Соотношение CuSO4 : Аскорбат натрия | 1 : 50 | |
Таблица 2: Пиколил-Азид реагенты. n/a: неприменимо; *: свободный краситель;
| Label | Exc.max* [nm] |
Em.max* [nm] |
Пиколил-Азид |
| Флуоресцентные красители | |||
| 5/6-FAM | 490 | 510 | Picolyl-Azide-5/6-FAM |
| Sulfo-Cy3 | 553 | 566 | Picolyl-Azide-Sulfo-Cy3 |
| 5/6-TAMRA | 546 | 565 | Picolyl-Azide-5/6-TAMRA |
| Sulfo-Cy5 | 647 | 663 | Picolyl-Azide-Sulfo-Cy5 |
| Cy7 | 553 | 566 | Picolyl-Azide-Cy7 |
| Биотинилированный реагент | |||
| Биотин | n/a | n/a | Picolyl-Azide-PEG4-Biotin |
Также вас могут заинтересовать алкин-модифицированные КЛИК-реагенты для работы с ДНК, тотальной РНК, поли(А) хвостом мРНК и мониторинга синтеза белка.
Литература:
[1] Presolski et al. (2011) Copper-Catalyzed Azide-Alkyne Click Chemistry for Bioconjugation. Current Protocols in Chemical Biology 3:153.
[2] Hong et al. (2011) Analysis and Optimization of Copper-Catalyzed Azide-Alkyne Cycloaddition for Bioconjugation. Angew. Chem. Int. Ed. 48:9879.
[3] Uttamapinant et al. (2012) Fast, Cell-Compatible Click Chemistry with Copper-Chelating Azides for Biomolecular Labeling. Angew. Chem. Int. Ed. 51:5852.
[4] Uttamapinant et al. (2013) Site-specific protein labeling using PRIME and chelation-assisted click chemistry. Nature Protocols 8:1620.
[5] Jiang et al. (2014) Monitoring Dynamic Glycosylation in Vivo Using Supersensitive Click Chemistry. Bioconjug. Chem. 25 (4):698.
Информация представлена исключительно в ознакомительных целях и ни при каких условиях не является публичной офертой